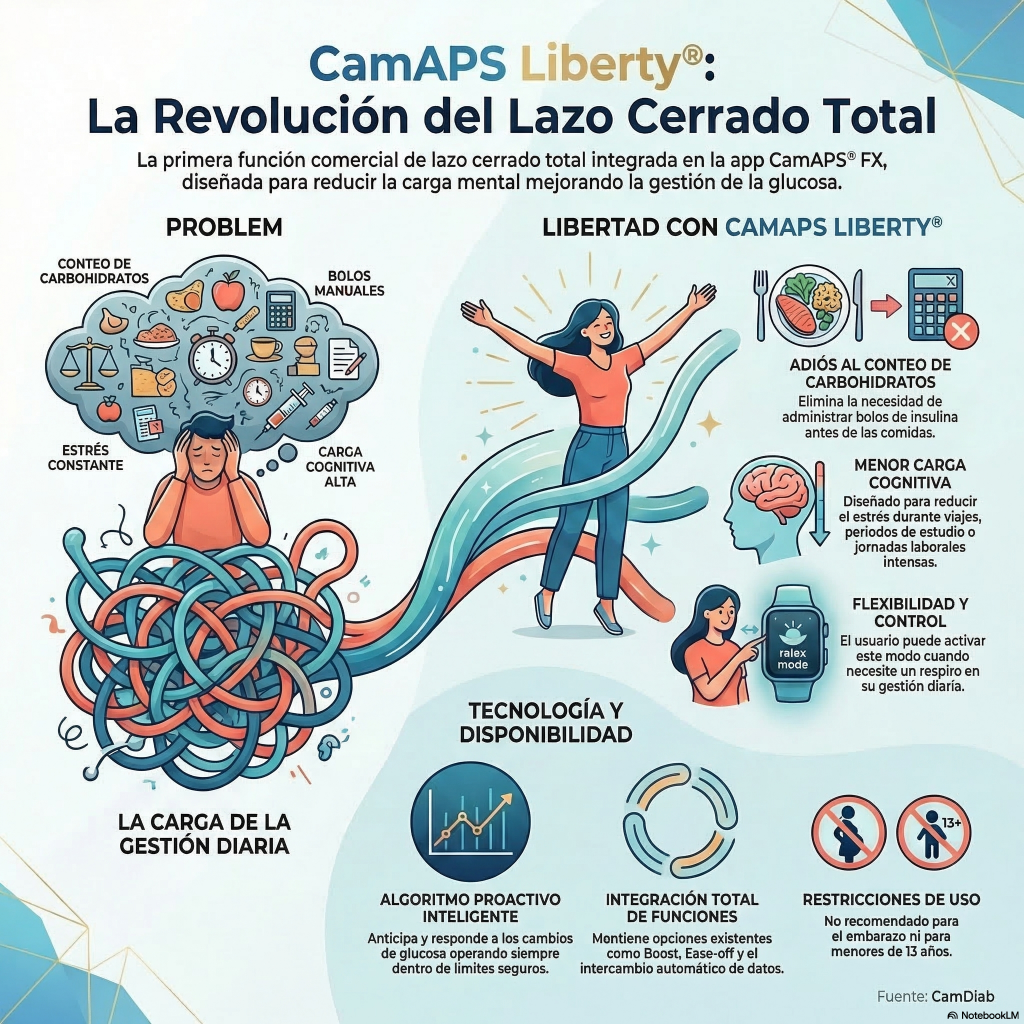
El texto detalla el lanzamiento de CamAPS Liberty , una función pionera diseñada para transformar el tratamiento de la diabetes tipo 1 mediante un sistema de bucle cerrado completamente automatizado . Esta innovación, integrada en la aplicación CamAPS FX, permite a los pacientes suspender el conteo de carbohidratos y la administración manual de bolos de insulina durante las comidas. El objetivo principal es reducir la carga mental y mejorar la calidad de vida de los usuarios en momentos de alto estrés o exigencia personal. Utilizando un algoritmo proactivo y de autoaprendizaje, la tecnología ajusta la entrega de insulina de forma
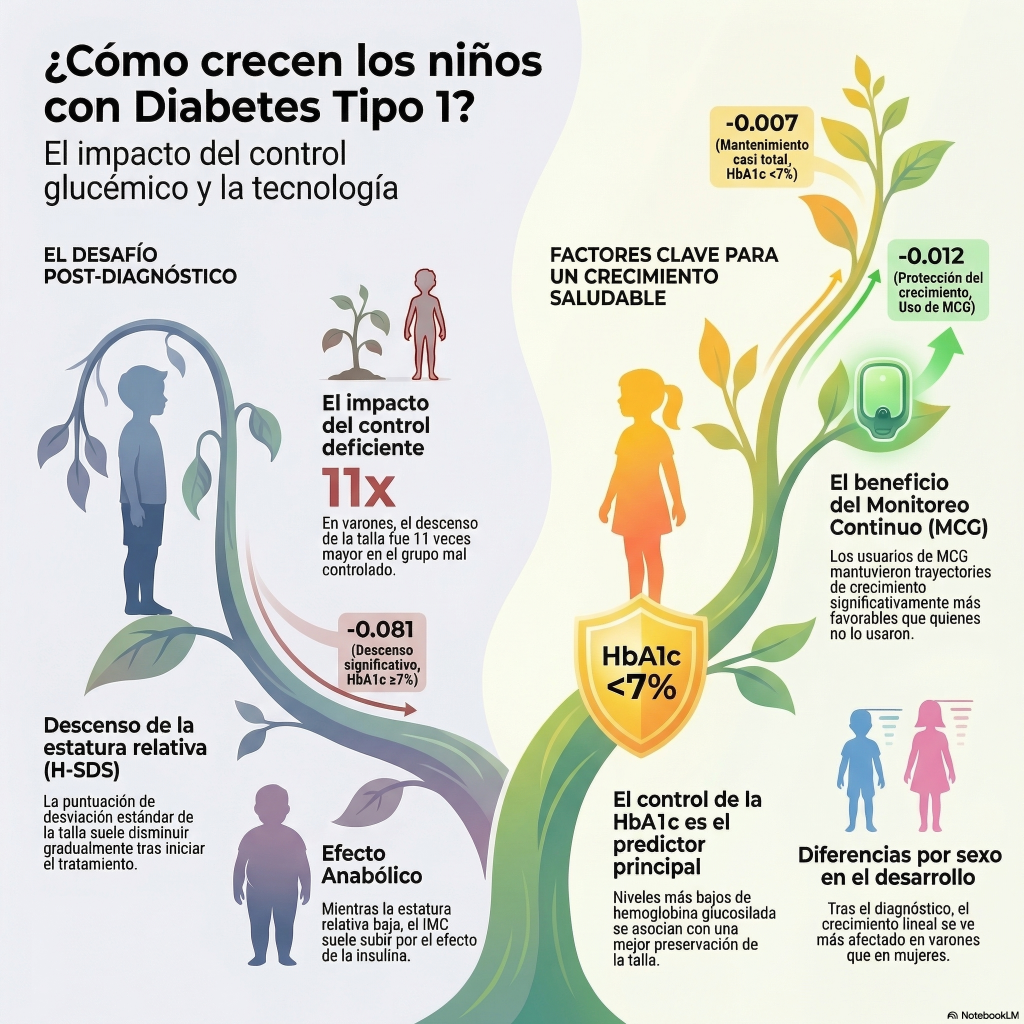
Este estudio retrospectivo analiza cómo la diabetes mellitus tipo 1 impacta el crecimiento lineal y el desarrollo físico de niños y adolescentes durante los cinco años posteriores al diagnóstico. Los investigadores determinaron que un control glucémico óptimo , reflejado en niveles bajos de hemoglobina glucosilada, es fundamental para prevenir una disminución significativa en la puntuación de separación estándar de la talla . El uso de sistemas de monitoreo continuo de glucosa mostró una compensación positiva con mejores trayectorias de crecimiento, especialmente en los varones, al facilitar una gestión metabólica más estable. Otros factores determinantes identificados incluyen el sexo del paciente
Estos documentos detallan las pautas clínicas necesarias para gestionar la diabetes de forma segura durante la preparación y ejecución de una colonoscopia . Debido a la falta de un protocolo universal, los textos enfatizan la importancia de realizar ajustes individualizados en la medicación, recomendando generalmente reducir la insulina basal a la mitad y suspender fármacos orales como la metformina o las sulfonilureas. Asimismo, se subraya la necesidad de realizar controles glucémicos constantes y mantener una ingesta controlada de carbohidratos líquidos para evitar episodios de hipoglucemia durante el ayuno. Los autores aconsejan programar la intervención a primera hora para facilitar el
Este informe de Roche presenta los resultados de una encuesta global que analiza el impacto de la diabetes en la autonomía y el bienestar emocional de millas de pacientes. Los datos revelan que la planificación constante de los niveles de glucosa y las medicamentos genera una pesada carga mental que dificulta tareas cotidianas como el trabajo, el deporte y el sueño . Ante la incertidumbre diaria que impone la enfermedad, una gran mayoría de los afectados expresa un fuerte interés en adoptar herramientas predictivas de salud. Estas tecnologías avanzadas permitirían anticipar cambios en el azúcar antes de que ocurran,
Las Normas de Atención en Diabetes 2026 de la Asociación Americana de Diabetes (ADA) subrayan que el bienestar psicológico y las conductas saludables son los pilares para optimizar los resultados médicos. El documento detalla que la Educación y Apoyo para el Autocontrol de la Diabetes (DSMES) y la Terapia de Nutrición Médica (MNT) deben ser procesos personalizados, culturalmente ajustados y constantes desde el diagnóstico. Se recomienda una alimentación basada en alimentos integrales y densos en nutrientes, evitando patrones rígidos y priorizando la reducción de productos procesados y azucarados. Respecto a la actividad física, se aconseja una combinación de ejercicios aeróbicos
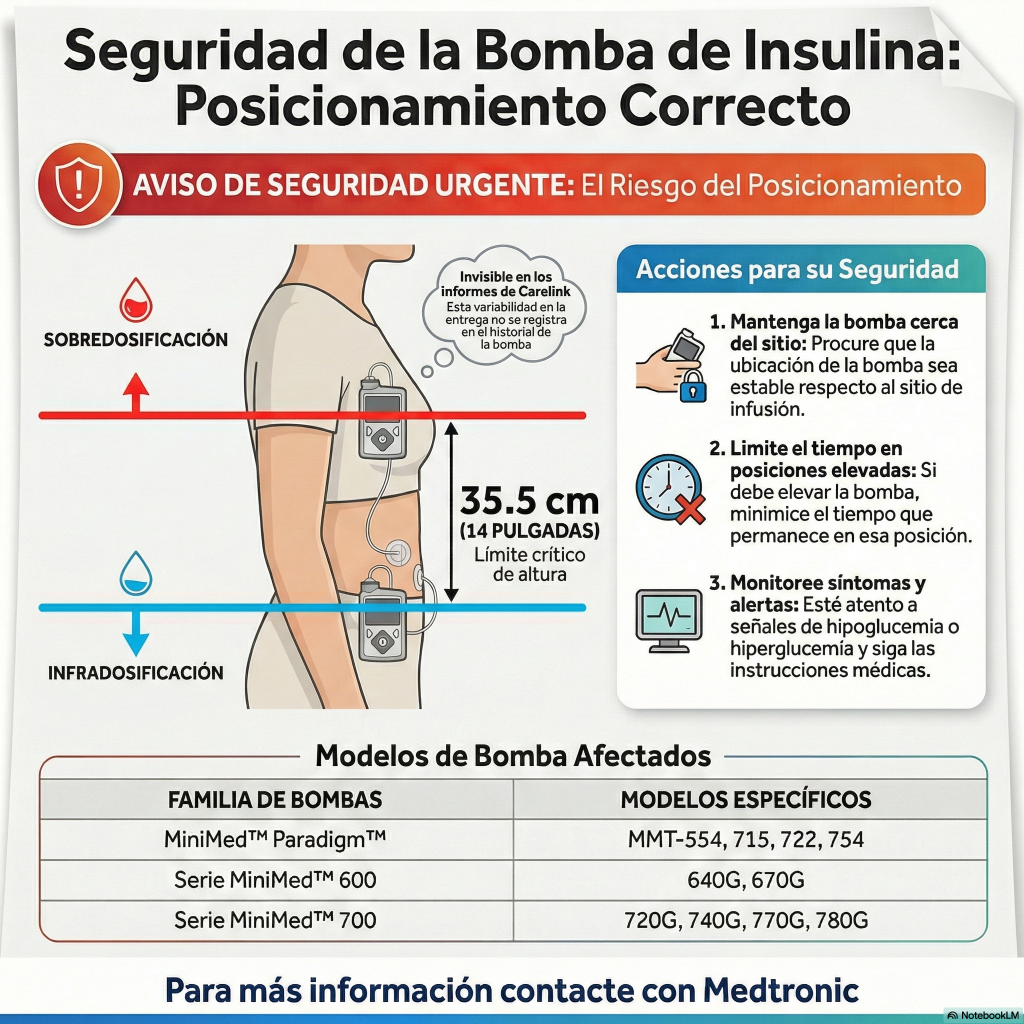
Esta notificación de seguridad urgente emitida por Medtronic advierte sobre un riesgo en la precisión de la dosificación de sus bombas de insulina de las series Paradigm, 600 y 700. El fabricante explica que la posición física del dispositivo en relación con el lugar de la infusión puede alterar la cantidad de medicamento suministrado debido a factores ambientales. Específicamente, colocar la bomba a más de 35,5 centímetros por encima o por debajo del sitio de inyección podría provocar niveles incorrectos de insulina, resultando en hipoglucemia o hiperglucemia. Para mitigar este peligro, instruye a los usuarios a mantener el aparato cerca
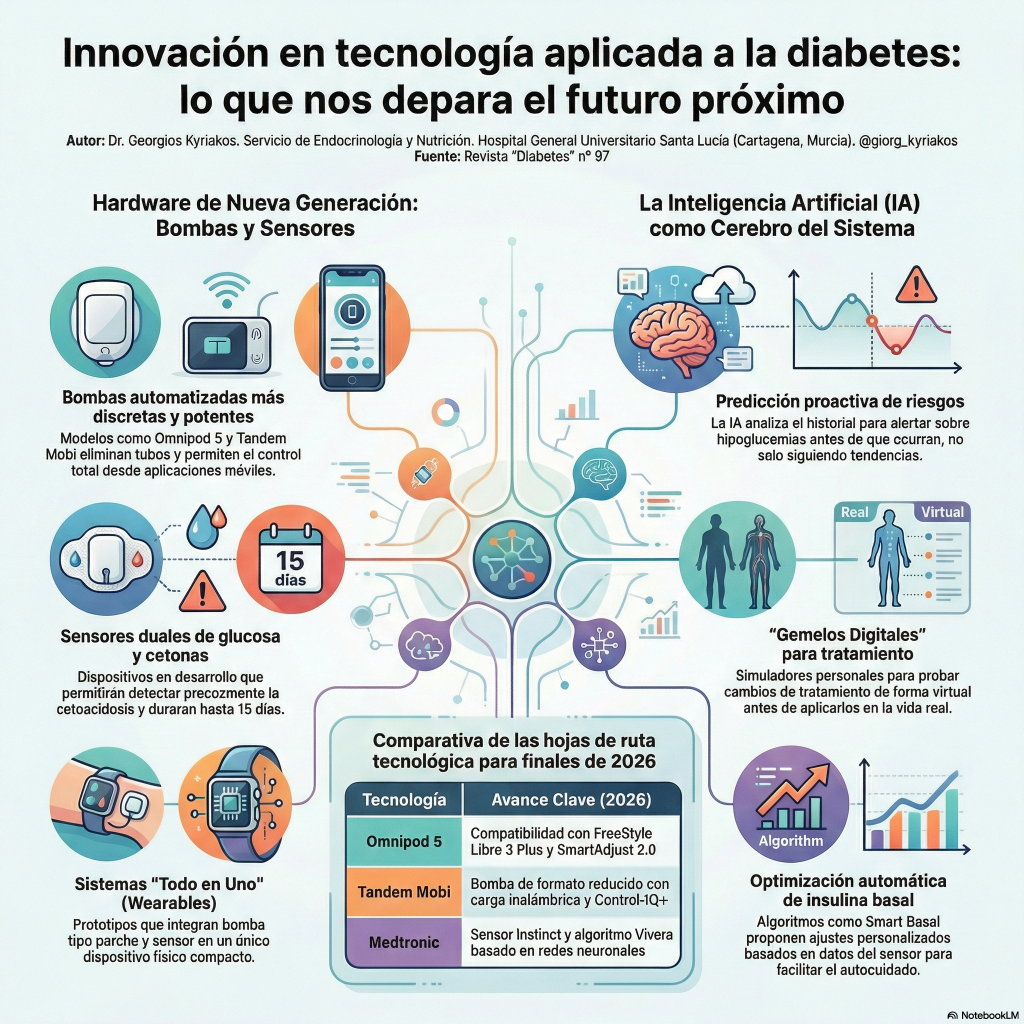
«Este artículo detalla los próximos avances en tecnología para la diabetes , destacando la transición hacia dispositivos que operan de manera conjunta y automatizada. Se describen bombas de insulina de nueva generación y algoritmos de inteligencia artificial que no solo ajustan dosis, sino que también predicen variaciones glucémicas para reducir riesgos. El texto resalta la llegada de sensores más duraderos y capaces de medir simultáneamente la glucosa y las cetonas para una vigilancia metabólica integral. Finalmente, el autor enfatiza que la meta futura es integrar estos elementos en sistemas de circuito cerrado que disminuyen la carga diaria del paciente.
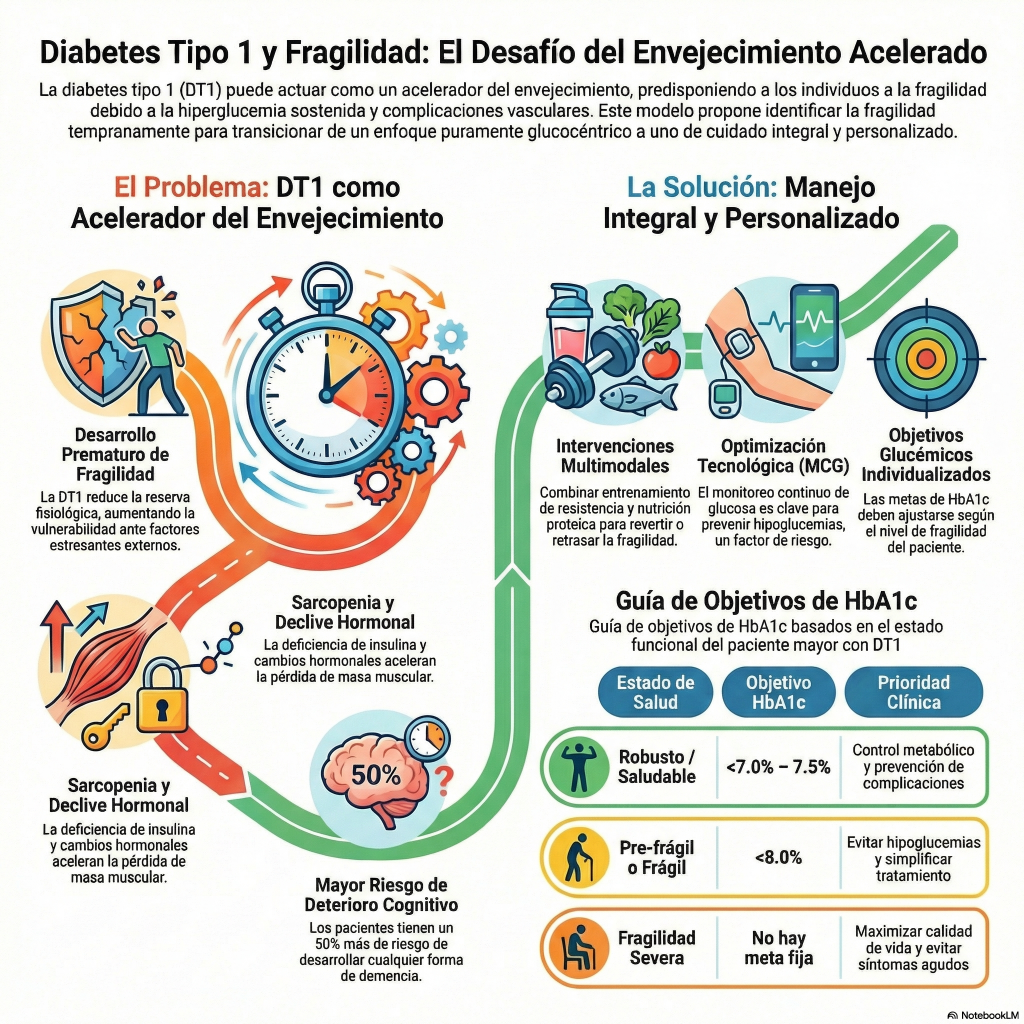
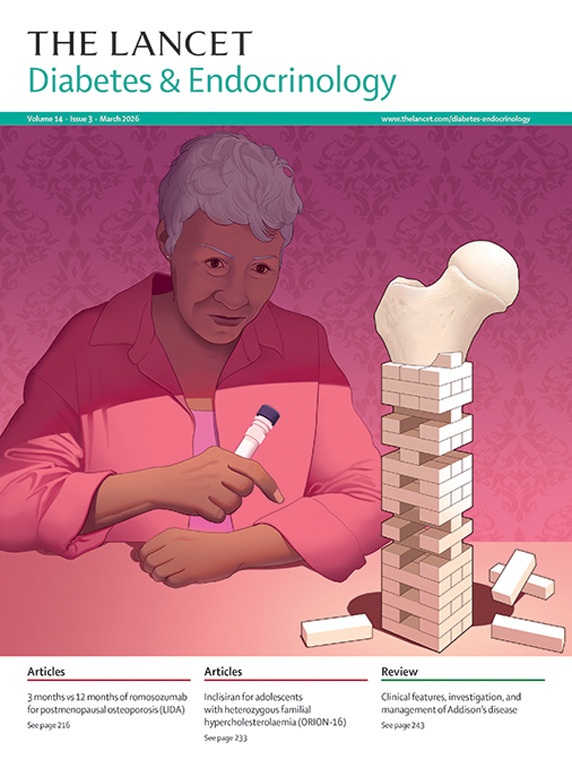
«Este artículo académico analiza la creciente intersección entre el envejecimiento, la fragilidad y la diabetes tipo 1 , un área que ha sido históricamente menos estudiada que en la diabetes tipo 2. Los autores explican cómo la exposición prolongada a la hiperglucemia y las hipoglucemias graves pueden acelerar el deterioro físico y cognitivo, incrementando el riesgo de sufrir síndromes geriátricos y discapacidad. El texto detalla los mecanismos fisiopatológicos , como la inflamación crónica y la sarcopenia, que vinculan esta condición metabólica con una mayor vulnerabilidad ante estresores externos. Asimismo, se subraya la importancia de implementar herramientas de evaluación geriátrica
Este comunicado de prensa anuncia el lanzamiento en Estados Unidos de una solución tecnológica avanzada para personas con diabetes tipo 1 . Las empresas Sequel Med Tech y Senseonics han integrado el sistema de infusión automatizada de insulina twiist™ con el sensor de glucosa Eversense® 365 . Esta colaboración destaca por ofrecer el primer sistema compatible con un monitor implantable que dura un año completo, eliminando la necesidad de cambios frecuentes de sensores. El objetivo principal de esta innovación es reducir la carga diaria del tratamiento, brindando mayor flexibilidad, precisión y comodidad a los pacientes. Con esta disponibilidad nacional,
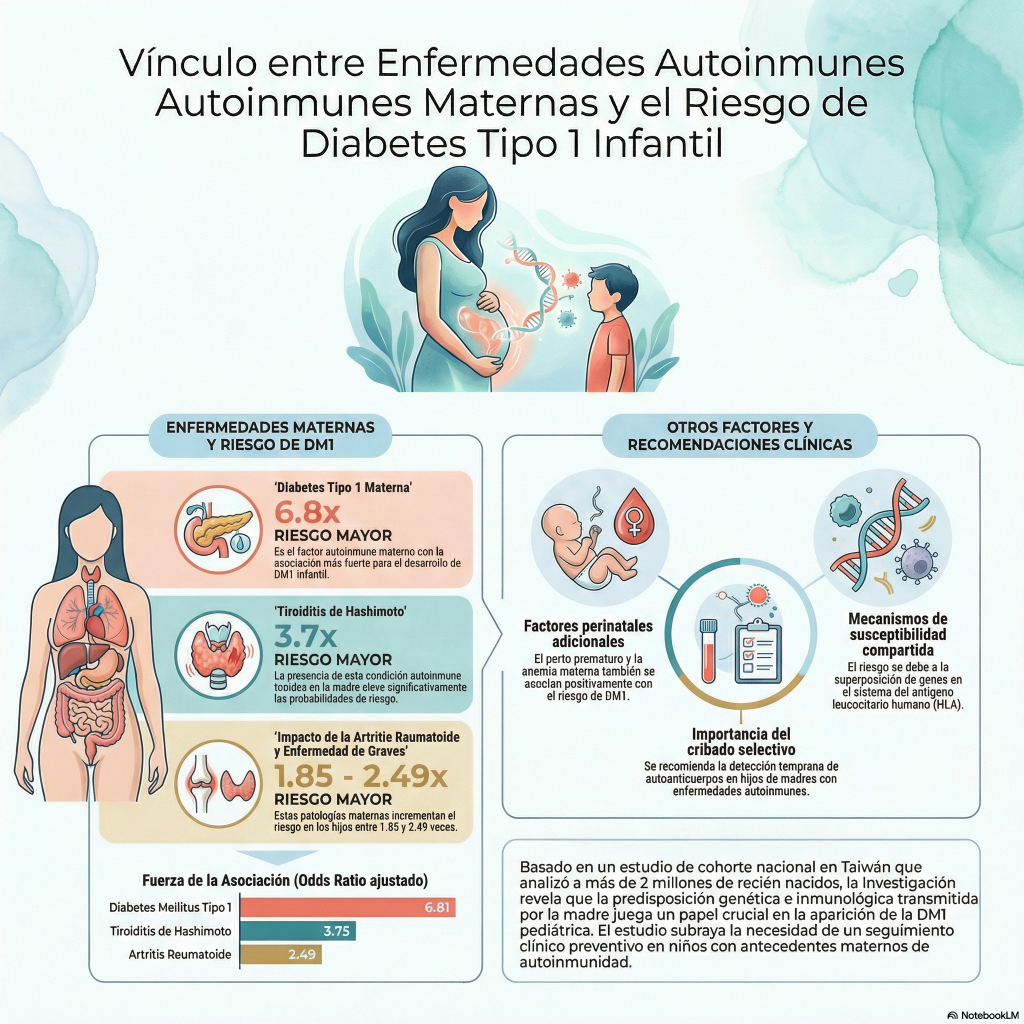
Este estudio de investigación analiza cómo las enfermedades autoinmunes maternas influyen en la probabilidad de que los hijos desarrollen diabetes tipo 1 durante la infancia. Utilizando datos poblacionales de Taiwán entre 2004 y 2020, los autores determinan que los niños nacidos de madres con condiciones como artritis reumatoide , tiroiditis de Hashimoto o la propia diabetes tipo 1 enfrentan un riesgo significativamente mayor. El documento detalla que factores genéticos compartidos y posibles mecanismos epigenéticos durante el embarazo podrían explicar esta conexión intergeneracional. Además, se identificaron otras variables influyentes como el parto prematuro , los bajos ingresos familiares y la presencia
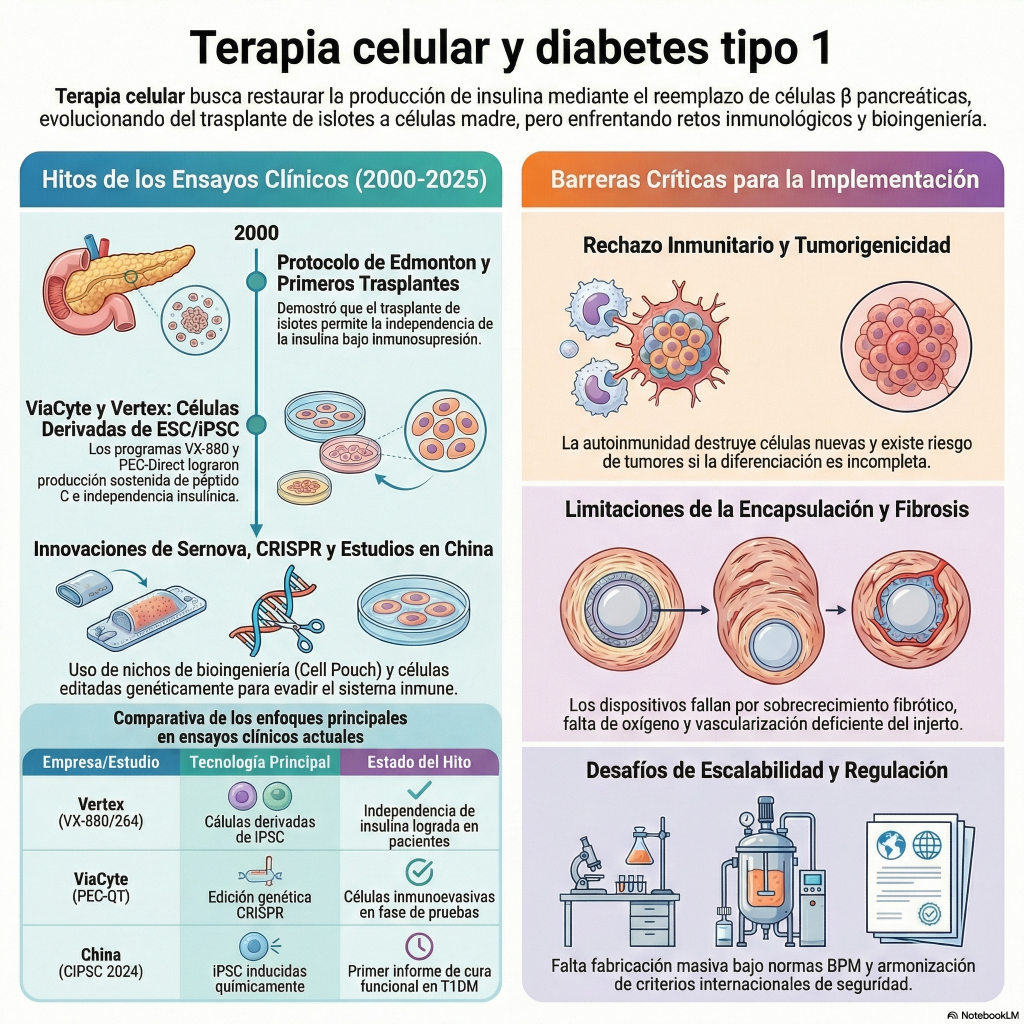
Esta fuente analiza la evolución de las terapias con células madre para el tratamiento de la diabetes, pasando de los trasplantes de islotes tradicionales a técnicas avanzadas de medicina regenerativa . El texto detalla el uso de células madre embrionarias, pluripotentes inducidas y mesenquimales, destacando hitos clínicos de empresas como Vertex y ViaCyte que buscan la independencia de la insulina. Se exploran innovaciones cruciales como la encapsulación de células y la edición genética con CRISPR para proteger los injertos del rechazo inmunológico sin necesidad de fármacos inmunosupresores. A pesar de los éxitos recientes, el artículo subraya que persisten desafíos
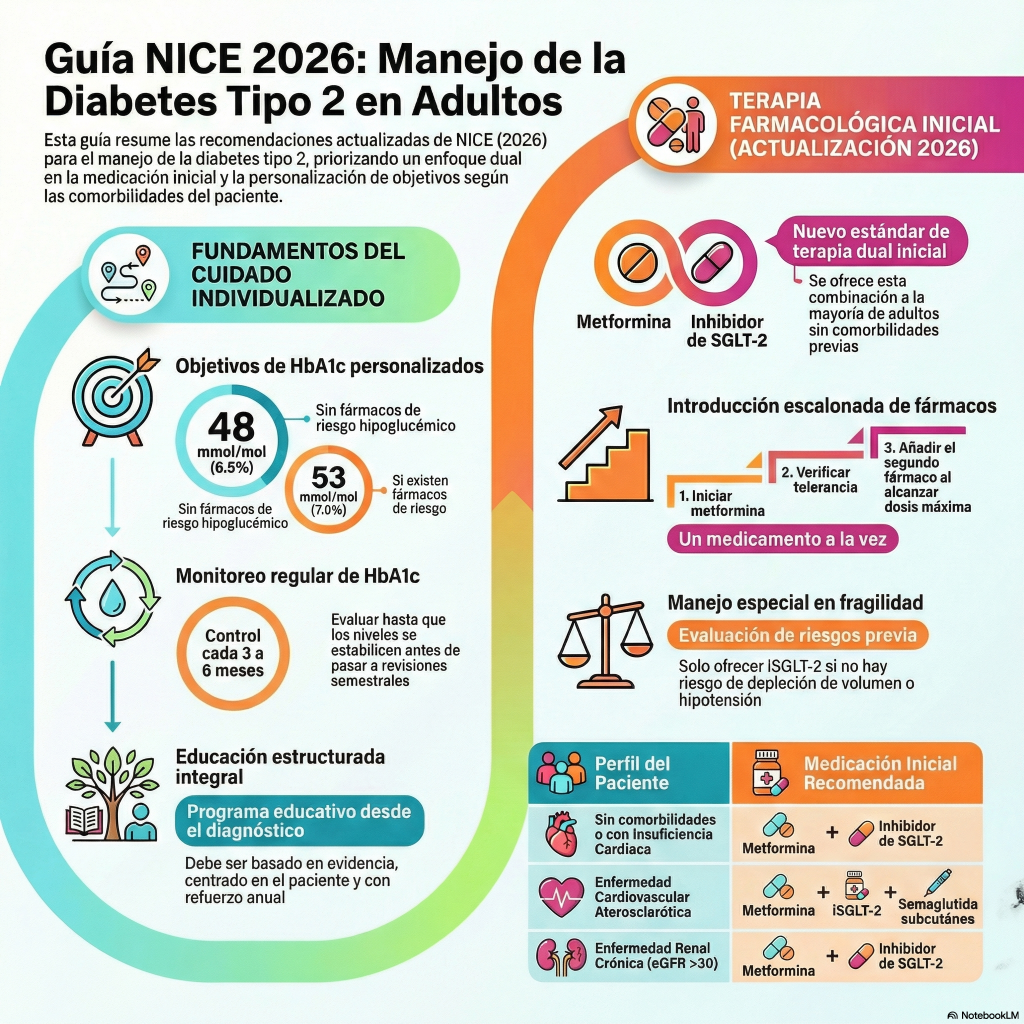
Esta guía clínica detalla el manejo integral de la diabetes tipo 2 en adultos , subrayando la importancia de un enfoque personalizado centrado en el paciente. El documento ofrece directrices actualizadas sobre el control de la glucosa , incluyendo el uso de tecnologías de monitoreo continuo y la fijación de objetivos de HbA1c adaptados a cada individuo. Se proporcionan esquemas terapéuticos específicos para personas con comorbilidades como insuficiencia cardíaca, enfermedad renal crónica u obesidad, destacando el papel de los inhibidores de SGLT-2 y los agonistas de GLP-1. Además, la fuente resalta la relevancia de la educación estructurada , el asesoramiento
Personas con diabetes y cuidadores
Profesionales
Contenidos más visitados