Un estudio pionero, el primero en humanos, establece el potencial para tratar la diabetes tipo 1 mediante el trasplante de células secretoras de insulina sin inmunosupresión.
Los resultados del seguimiento de seis meses de los pacientes demuestran que las células de los islotes pancreáticos trasplantadas de Sana modificadas con su tecnología hipoinmune (HIP) son seguras y bien toleradas, sobreviven, evaden la detección del sistema inmunitario y continúan produciendo insulina en el paciente.
La función y la persistencia de los islotes pancreáticos se detectaron mediante la producción de niveles constantes de péptido C circulante, un marcador de producción de insulina, y niveles elevados de péptido C con una prueba de tolerancia a comidas mixtas (MMTT).
La resonancia magnética muestra señales consistentes con la supervivencia del injerto seis meses después del trasplante
Continúa el estudio para evaluar la seguridad, la supervivencia y la función de las células trasplantadas
Datos compartidos en una presentación por invitación en las 85.ª sesiones científicas anuales de la Asociación Estadounidense de Diabetes (ADA) hoy
Sana está incorporando la tecnología probada de evasión inmunitaria para desarrollar SC451, una terapia derivada de células madre modificada por HIP como tratamiento único para pacientes con diabetes tipo 1, con el objetivo de lograr niveles normales de glucosa en sangre, sin insulina ni inmunosupresión.
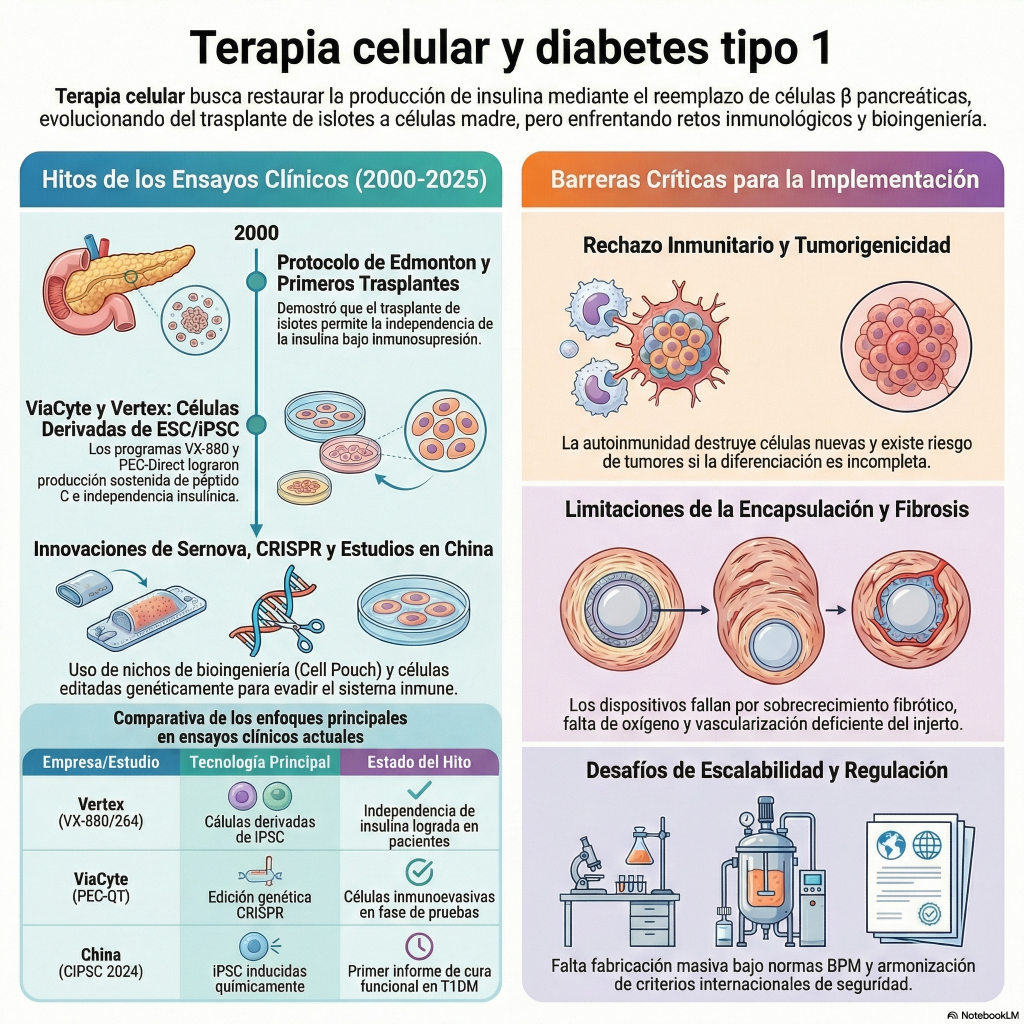
SEATTLE, 23 de junio de 2025 (GLOBE NEWSWIRE) — Sana Biotechnology, Inc. (NASDAQ: SANA), empresa dedicada a cambiar las posibilidades de los pacientes mediante la ingeniería celular, anunció hoy los resultados de un estudio de seguimiento a seis meses de un estudio pionero en humanos, patrocinado por investigadores, en el que se trasplantó UP421, una terapia alogénica de células de islotes primarias diseñada con la tecnología hipoinmune (HIP) de Sana, a un paciente con diabetes tipo 1 sin inmunosupresión. El estudio se lleva a cabo en colaboración con el Hospital Universitario de Uppsala. Los resultados concuerdan con los resultados clínicos de cuatro y doce semanas, y se basan en ellos, previamente informados. Los resultados del estudio a los seis meses del trasplante celular demuestran la supervivencia y la función de las células beta pancreáticas, medidas mediante la presencia de péptido C circulante, un biomarcador que indica que las células beta trasplantadas producen insulina. Los niveles de péptido C también aumentan con una prueba de tolerancia a comidas mixtas (MMTT), en consonancia con la secreción de insulina en respuesta a una comida. La tomografía por emisión de positrones (TEP) y resonancia magnética (RM) a las 12 semanas también mostró células de los islotes en el sitio del trasplante, un músculo del antebrazo. El estudio no identificó problemas de seguridad, y las células de los islotes modificadas con HIP evadieron la respuesta inmunitaria.
“Como endocrinólogo que ha dedicado su carrera a mejorar los resultados de los pacientes con diabetes tipo 1, me complace compartir estos emocionantes resultados. En consonancia con los datos de cuatro y doce semanas publicados previamente, creemos que la actualización de hoy, a seis meses, sigue sugiriendo que es posible una cura funcional para la diabetes tipo 1 sin inmunosupresión”, afirmó el Dr. Per-Ola Carlsson, investigador principal del estudio, médico sénior y profesor de la Clínica de Endocrinología y Diabetología del Hospital Universitario de Uppsala. “Estos resultados revolucionarios se basan en los extensos estudios preclínicos y translacionales de la Dra. Sonja Schrepfer y el equipo de Sana, y brindan esperanza de una cura. Esperamos continuar el seguimiento y publicar los resultados del estudio en una revista con revisión por pares”.
“La supervivencia, la función y la evasión inmunitaria a largo plazo de las células de los islotes pancreáticos alogénicas trasplantadas sin medicamentos inmunosupresores, especialmente en el contexto de una respuesta autoinmune preexistente a estas células, representa un paso transformador y necesario para hacer más accesible la medicina celular y de trasplantes”, afirmó el Dr. Steve Harr, presidente y director ejecutivo de Sana. “La diabetes tipo 1 afecta actualmente a más de nueve millones de personas en todo el mundo, y ha habido relativamente pocos avances transformadores en esta enfermedad desde el descubrimiento de la insulina hace más de 100 años. Los datos presentados hoy acercan nuestra visión: tratar la diabetes con una terapia ampliamente disponible que permita un control normal de la glucemia sin insulina ni inmunosupresión. Estamos incorporando los conocimientos y la tecnología de evasión inmunitaria del actual ensayo UP421 para desarrollar SC451, una terapia de células de los islotes derivadas de células madre modificadas con HIP, para la cual tenemos previsto presentar una solicitud de nuevo fármaco en investigación (IND) el próximo año”.
Aaron J. Kowalski, Ph.D., director ejecutivo de Breakthrough T1D (anteriormente conocido como JDRF), añadió: «Hace tiempo que se necesita un cambio de paradigma en el tratamiento de la diabetes. Durante más de un siglo, la administración de insulina exógena ha sido la única terapia para esta enfermedad crónica. Mejoras significativas en la terapia con insulina, como los sistemas automatizados de administración de insulina, han mejorado los resultados de muchas personas que viven con esta enfermedad. Sin embargo, la mayoría de las personas con diabetes tipo 1 aún no logran alcanzar niveles ideales de glucosa, lo que aumenta el riesgo de complicaciones, como enfermedades cardiovasculares, enfermedades renales y otras. La posibilidad de administrar células productoras de insulina a personas con esta enfermedad, lo que permite un control glucémico estable sin inyecciones de por vida, fármacos que inhiben el sistema inmunitario ni un control diario constante, representa un avance transformador y potencialmente transformador. Agradecemos enormemente la colaboración de los equipos de investigación de Sana, el Hospital Universitario de Uppsala y todos los involucrados, por su dedicación a este trabajo. Todo el equipo de Breakthrough T1D espera colaborar con Sana y otros para garantizar que todos los miembros de la comunidad de la diabetes tipo 1… “Pueden beneficiarse de estos avances que cambian la vida”.
El trasplante primario de células de islotes con inmunosupresión es un procedimiento establecido en la diabetes tipo 1, en el que se aíslan células de islotes pancreáticos alogénicas del páncreas de un donante fallecido y se trasplantan a un paciente con el objetivo de lograr un control normal de la glucemia y una independencia insulínica. Al igual que con los trasplantes de órganos completos, históricamente se ha requerido la supresión del sistema inmunitario del receptor para prevenir el rechazo inmunitario de las células trasplantadas alogénicas y la reaparición del ataque autoinmunitario desencadenante. La tecnología HIP de Sana está diseñada para superar el rechazo inmunológico de las células alogénicas y, en la diabetes tipo 1, también para evadir el rechazo autoinmunitario de las células beta pancreáticas. Las células UP421 se trasplantaron sin inmunosupresión, y la supervivencia de estas células de islotes demuestra que evaden la detección tanto alogénica como autoinmunitaria.
Acerca del estudio de UP421 en diabetes tipo 1 patrocinado por investigadores del Hospital Universitario de Uppsala
El estudio de UP421 patrocinado por investigadores cuenta con el apoyo de una beca de The Leona M. and Harry B. Helmsley Charitable Trust. El estudio evalúa si las células pancreáticas productoras de insulina modificadas mediante HIP pueden trasplantarse de forma segura y ayudar a recuperar la producción de insulina en personas con diabetes tipo 1 sin necesidad de tratamiento simultáneo con medicamentos inmunosupresores. Para ello, UP421 se diseña utilizando la plataforma HIP de Sana en el Hospital Universitario de Oslo. El estudio implica el trasplante quirúrgico intramuscular de células de islotes modificadas mediante HIP primarias o derivadas de donantes en el antebrazo de pacientes con diabetes tipo 1. El objetivo principal del estudio es investigar la seguridad del trasplante de UP421 en pacientes con diabetes tipo 1, con criterios de valoración secundarios que incluyen la supervivencia celular, la evasión inmunitaria y la producción de péptido C. El péptido C circulante es una medida de la producción endógena de insulina. Este primer estudio en humanos examina una dosis baja de islotes primarios modificados con HIP para establecer inicialmente la seguridad y la función de los islotes modificados con HIP sin inmunosupresión y, como resultado, no pretende mostrar una mejora en la glucemia o una reducción en la administración de insulina exógena.
Los resultados del estudio, realizado durante seis meses tras el trasplante de células de los islotes pancreáticos, demuestran la supervivencia y la función de las células beta pancreáticas hasta el sexto mes, medida mediante la presencia de péptido C circulante, un biomarcador que indica que las células beta trasplantadas producen insulina. Los niveles de péptido C también aumentan durante un MMTT, lo que coincide con la secreción de insulina en respuesta a una comida. Al inicio, el paciente tenía niveles indetectables de péptido C tanto en ayunas como durante un MMTT. La exploración PET-MRI a las 12 semanas también mostró células de los islotes pancreáticos en el lugar del trasplante, un músculo del antebrazo. La plataforma HIP ha logrado una prueba de concepto en humanos, mostrando la evasión del reconocimiento inmunitario con una posible aplicación amplia para el trasplante alogénico sin inmunosupresión.
Acerca de la Plataforma Hipoinmune (HIP) de Sana Biotechnology.
La plataforma HIP de Sana está diseñada para generar células ex vivo que pueden evadir el sistema inmunitario del paciente y permitir el trasplante de células alogénicas sin necesidad de inmunosupresión. Aplicamos la tecnología HIP para desarrollar candidatos terapéuticos a gran escala, incluyendo células madre pluripotentes, que luego pueden diferenciarse en múltiples tipos celulares, como células de los islotes pancreáticos y células T CAR alogénicas derivadas de donantes. Nosotros y nuestros colaboradores hemos generado una importante propiedad intelectual fundacional en este campo. Los primeros datos clínicos de los ensayos de Fase 1 y los datos preclínicos publicados en revistas con revisión por pares demuestran, en diversos tipos celulares, que estas células alogénicas trasplantadas son capaces de evadir tanto las ramas innatas como adaptativas del sistema inmunitario, manteniendo al mismo tiempo su actividad. Los programas más avanzados de Sana que utilizan esta plataforma incluyen un programa de células de islotes pancreáticos derivados de células madre para la diabetes tipo 1, un programa CAR T alogénico para enfermedades autoinmunes mediadas por células B y un programa CAR T alogénico dirigido a cánceres CD22+.
Acerca de Sana Biotechnology.
Sana Biotechnology, Inc. se centra en la creación y administración de células modificadas genéticamente como medicamentos para pacientes. Compartimos la visión de reparar y controlar genes, reemplazar células faltantes o dañadas y hacer que nuestras terapias estén ampliamente disponibles para los pacientes. Somos un grupo apasionado de personas que trabajamos juntas para crear una empresa perdurable que transforma la forma en que el mundo trata las enfermedades. Sana opera en Seattle, Washington; Cambridge, Massachusetts; South San Francisco, California; y Bothell, Washington. Para más información sobre Sana Biotechnology, visite https://sana.com/ .
Nota de advertencia sobre las declaraciones prospectivas
Este comunicado de prensa contiene declaraciones prospectivas sobre Sana Biotechnology, Inc. (la “Compañía”, “nosotros”, “nos” o “nuestro”) dentro del significado de las leyes federales de valores, incluidas las relacionadas con la visión, el progreso y los planes comerciales de la Compañía; expectativas para sus programas de desarrollo, productos candidatos y plataformas tecnológicas, incluidos sus planes de desarrollo preclínico, clínico y regulatorio y expectativas de tiempo, incluso con respecto al momento y la sustancia de los posibles IND, y el programa SC451 de la Compañía, incluida la capacidad potencial de SC451 para administrarse como un tratamiento único y ampliamente disponible para pacientes con diabetes tipo 1 y para lograr una glucosa en sangre normal sin inyecciones de insulina o inmunosupresión; El impacto potencial y la importancia de los datos del estudio UP421 sobre el trasplante de células de islotes sin inmunosupresión en la diabetes tipo 1 (el «Estudio»), incluyendo el potencial para trasplantar células secretoras de insulina y desarrollar una cura funcional para el tratamiento de la diabetes tipo 1 sin inmunosupresión y la accesibilidad a medicamentos celulares y de trasplante; las expectativas con respecto a la presentación en las 85.ªs Sesiones Científicas Anuales de la Asociación Americana de la Diabetes; la capacidad de la plataforma HIP para generar células ex vivo. that can evade the patient’s immune system to enable the transplantation of allogeneic cells without the need for immunosuppression and, in type 1 diabetes, enable transplanted pancreatic beta cells to avoid autoimmune rejection, to have broad application for allogeneic transplantation without immunosuppression, and to be applied to develop therapeutic candidates at scale, including pluripotent stem cells that can be differentiated into multiple cell types and donor-derived allogeneic CAR T cells; expectations with respect to Study follow-up and submission and publication of Study results; the potential safety and survival, function, and evasion of immune detection of HIP-modified primary pancreatic islet cells transplanted intramuscularly with no immunosuppression; the potential impact of administering insulin-producing cells to enable stable glycemic control without lifelong injections, immune-suppressing drugs, or constant daily management, including the potential to benefit members of the type 1 diabetes community; the potential application of the learnings from the Study to the Company’s SC451 program; the potential significance of the survival of UP421 cells in the Study; and statements made by Study Principal Investigator, Senior Physician and Professor at the Clinic for Endocrinology and Diabetology at Uppsala University Hospital, statements made by the Company’s President and CEO, and statements made by the CEO of Breakthrough T1D (previously known as JDRF). All statements other than statements of historical facts contained in this press release, including, among others, statements regarding the Company’s strategy, expectations, cash runway and future financial condition, future operations, and prospects, are forward-looking statements. In some cases, you can identify forward-looking statements by terminology such as “aim,” “anticipate,” “assume,” “believe,” “contemplate,” “continue,” “could,” “design,” “due,” “estimate,” “expect,” “goal,” “intend,” “may,” “objective,” “plan,” “positioned,” “potential,” “predict,” “seek,” “should,” “target,” “will,” “would,” and other similar expressions that are predictions of or indicate future events and future trends, or the negative of these terms or other comparable terminology. The Company has based these forward-looking statements largely on its current expectations, estimates, forecasts and projections about future events and financial trends that it believes may affect its financial condition, results of operations, business strategy and financial needs. In light of the significant uncertainties in these forward-looking statements, you should not rely upon forward-looking statements as predictions of future events. These statements are subject to risks and uncertainties that could cause the actual results to vary materially, including, among others, the risks inherent in drug development such as those associated with the initiation, cost, timing, progress and results of the Company’s current and future research and development programs, preclinical and clinical trials, as well as economic, market, and social disruptions. For a detailed discussion of the risk factors that could affect the Company’s actual results, please refer to the risk factors identified in the Company’s Securities and Exchange Commission (SEC) reports, including but not limited to its Quarterly Report on Form 10-Q dated May 8, 2025. Except as required by law, the Company undertakes no obligation to update publicly any forward-looking statements for any reason.
Relaciones con inversores y medios:
Nicole Keith
investor.relations@sana.com
media@sana.com
___