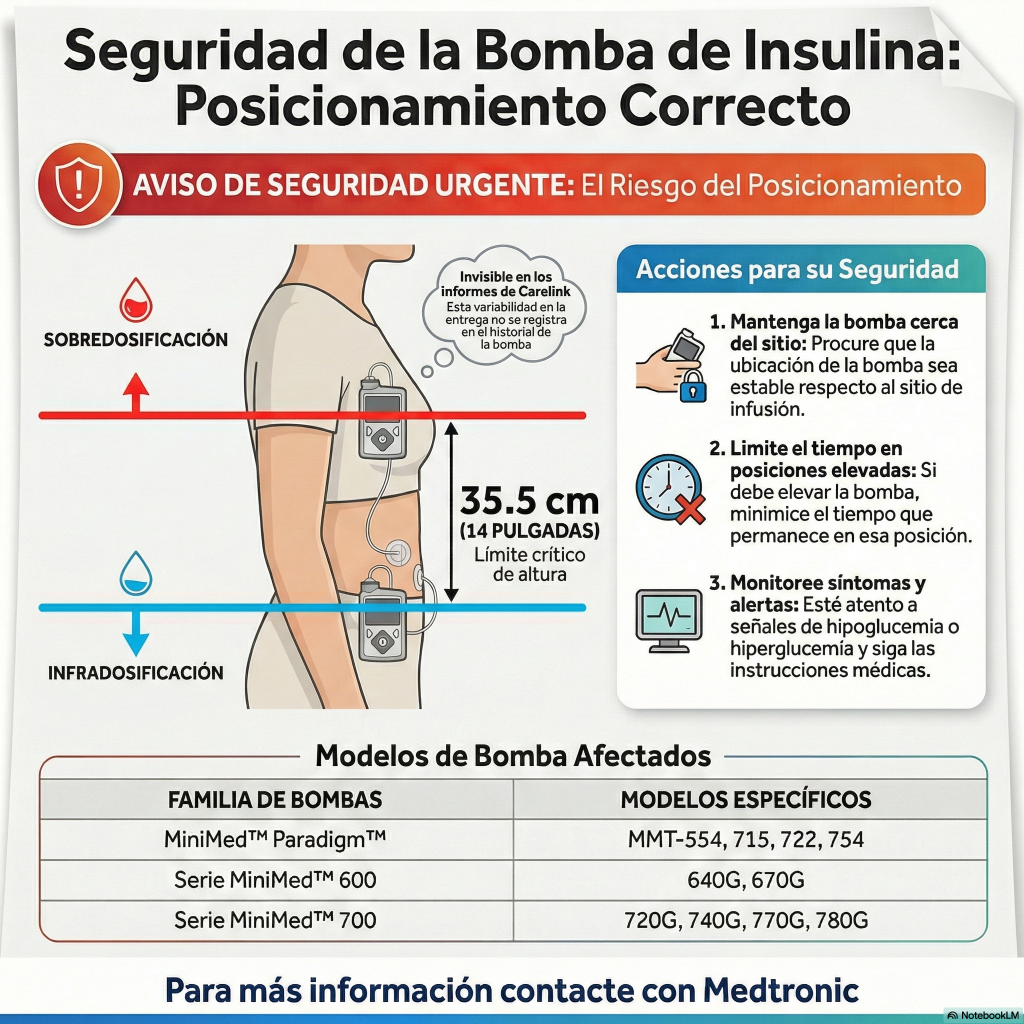
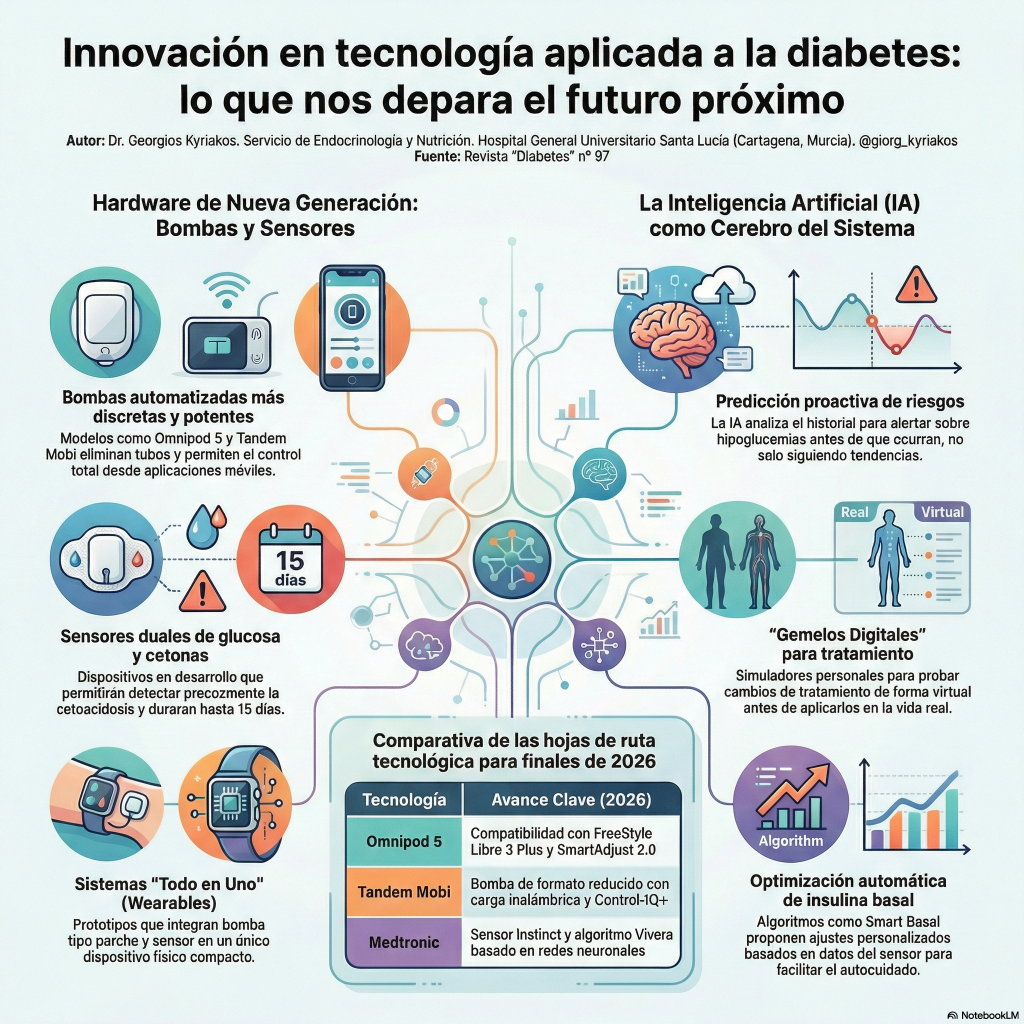
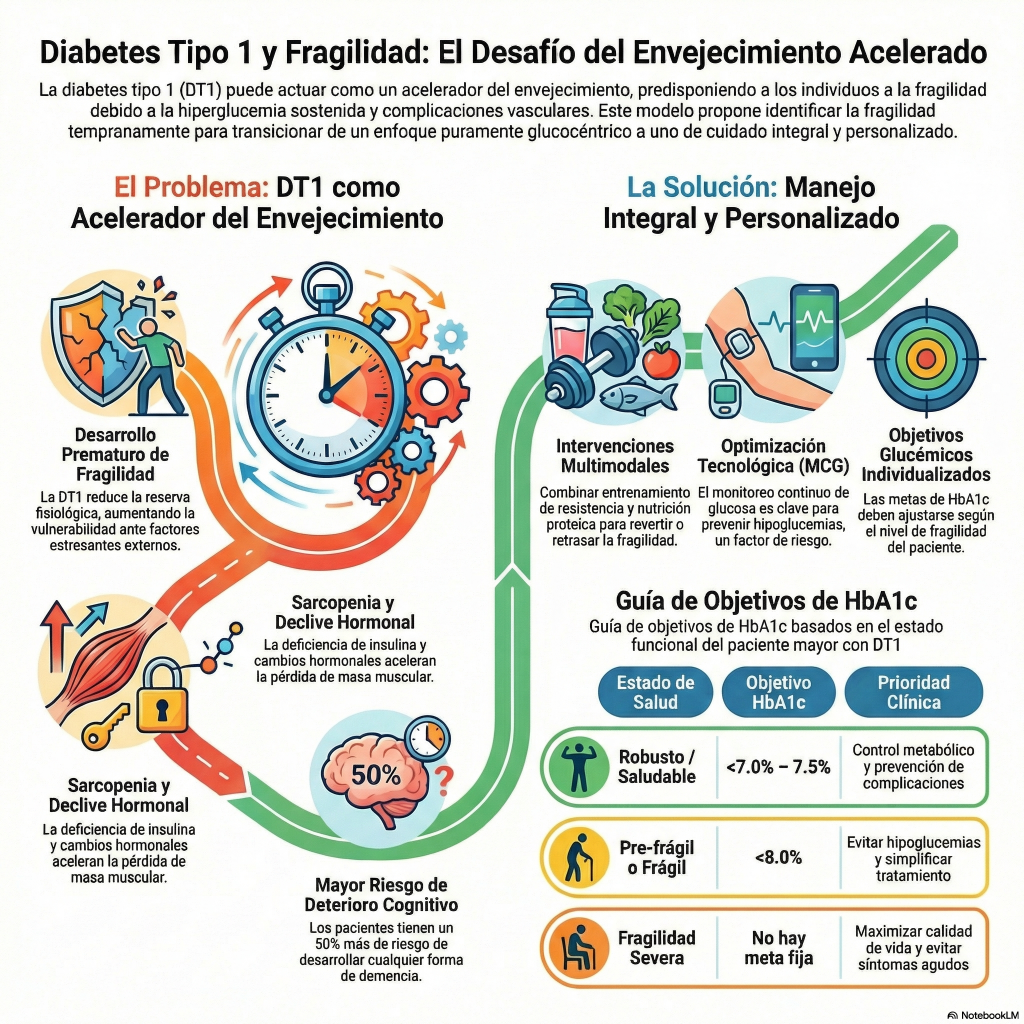
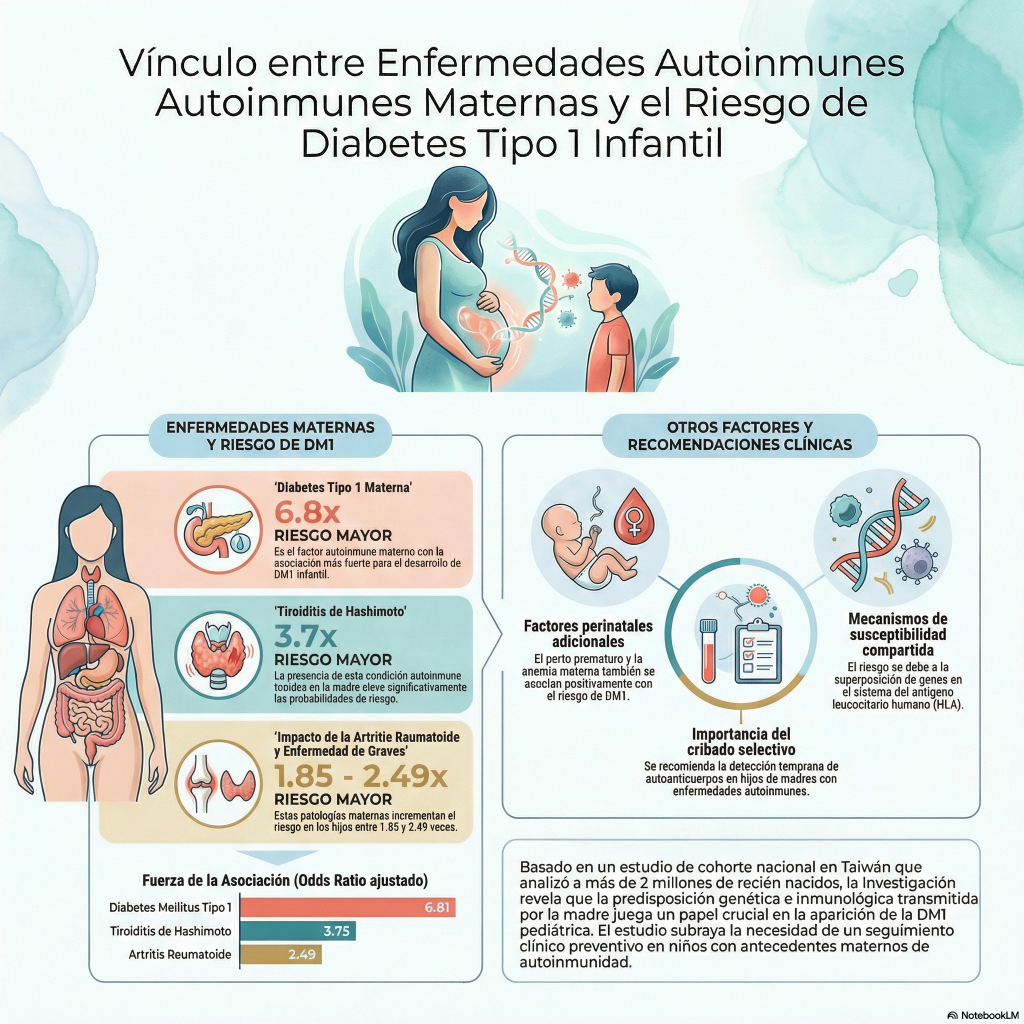
«Además de financiar la investigación, un componente clave de la estrategia de investigación de Breakthrough T1D es la promoción y la aplicación del conocimiento en ensayos clínicos. Aquí informamos sobre los resultados recientes de ensayos internacionales relevantes para nuestra comunidad de diabetes tipo 1 (DT1).
Para ver si hay investigaciones de reclutamiento activo en las que usted pueda participar, consulte nuestro Buscador de ensayos clínicos de diabetes tipo 1 .
Terapia celular: Ensayo con tegoprubart.
El trasplante de islotes actual (desde islotes de donantes cadavéricos en la práctica clínica hasta islotes derivados de células madre en ensayos clínicos) requiere inmunosupresión para protegerlos del sistema inmunitario del receptor. El Dr. Piotr Witkowski (Universidad de Chicago) está investigando el uso de tegoprubart como una alternativa menos tóxica al tacrolimus, comúnmente utilizado, para personas con diabetes tipo 1 que reciben trasplantes de islotes de donantes cadavéricos.
Tegoprubart (AT-1501) es un anticuerpo anti-CD40L propiedad de Eledon Pharmaceuticals y ha mostrado datos prometedores de seguridad y eficacia en trasplantes de riñón.
En el ensayo clínico de reemplazo de islotes, los datos preliminares de los primeros seis sujetos muestran que tegoprubart protege las células de los islotes de donantes cadavéricos trasplantados. Los seis sujetos trasplantados mostraron mejoras notables en el control glucémico, logrando y manteniendo la independencia de la insulina después de uno o dos trasplantes de islotes.
Tegoprubart fue generalmente bien tolerado, sin efectos adversos graves reportados ni signos de toxicidad renal o neurológica, que suelen observarse con la inmunosupresión tradicional.
Este ensayo clínico está financiado en parte por Breakthrough T1D International y Eledon Pharmaceuticals está financiado por el Breakthrough T1D Fund.
Terapia modificadora de la enfermedad: PETITE-T1D
Las terapias modificadoras de la enfermedad abordan la causa subyacente de la DT1, lo que significa que protegen las células beta, detienen el ataque autoinmune o ambos.
El ensayo PETITE-T1D de Sanofi evalúa la eficacia y seguridad de Tzield en niños de 0 a 7 años con diabetes tipo 1 en etapa temprana. Tzield está actualmente aprobado por Health Canada para niños y adultos de ocho años o más con diabetes tipo 1 en etapa 2, en quienes puede retrasar la aparición de la diabetes tipo 1 en etapa 3 una mediana de 3 años.
Los resultados provisionales del PETITE-T1D muestran que el perfil de seguridad de Tzield en niños menores de 8 años es similar al de las personas mayores que reciben el fármaco. Este estudio está en curso y esperamos obtener datos de eficacia (su eficacia en la reducción del ataque autoinmunitario) en 2026.
Terapia modificadora de la enfermedad: estudio de prevención con abatacept de TrialNet
Un nuevo análisis de TrialNet sobre el impacto de abatacept en la progresión de la diabetes tipo 1 sugiere que podría justificarse una mayor investigación.
Abatacept (nombre comercial: Orencia® ) es un medicamento biológico de venta con receta que se utiliza para tratar ciertas enfermedades autoinmunes. Actúa bloqueando la activación de las células T, un tipo de célula inmunitaria que causa inflamación.
El estudio de prevención de abatacept se inauguró en 2013 e inscribió a 212 personas de entre 6 y 45 años. Todos los participantes tenían al menos un familiar con diabetes tipo 1 y se les identificó como diabetes tipo 1 en estadio 1 (lo que significa que tenían dos o más autoanticuerpos relacionados con la diabetes, pero una tolerancia normal a la glucosa).
El análisis inicial del estudio encontró que, si bien abatacept afectó la respuesta inmunitaria y preservó la producción de insulina durante el período de tratamiento de un año, no cumplió con el objetivo del estudio de retrasar la progresión a una tolerancia anormal a la glucosa (diabetes tipo 1 en estadio 2) ni el diagnóstico clínico de diabetes tipo 1 (diabetes tipo 1 en estadio 3). El grupo tratado con abatacept mantuvo la función de las células beta mejor que el grupo placebo a los 12 meses. Además, se detectaron efectos conocidos de abatacept en las células inmunitarias. Sin embargo, 12 meses después de finalizar el tratamiento, la función de las células beta era la misma para ambos grupos y los efectos en las células inmunitarias se habían revertido. El efecto inicial no se mantuvo.
En un nuevo análisis de los datos, se encontró que los participantes que secretaban la mayor cantidad de insulina al inicio del ensayo fueron los que más se beneficiaron con Abatacept. Este es el primer indicio de que una intervención inmunitaria en la etapa 1 de la diabetes tipo 1 puede retrasar la progresión de la enfermedad en un subconjunto de individuos. A medida que los estudios sobre terapias modificadoras de la enfermedad profundizan en por qué ciertas personas responden mejor que otras, se está volviendo claro que se necesitará un enfoque de medicina de precisión para que las personas obtengan la terapia más beneficiosa posible.
Complicaciones renales: Finerenona
En noviembre de 2025, Bayer compartió datos del ensayo clínico internacional de fase 3 ( FINE-ONE ) que incluyó sitios participantes en todo Canadá. Estos resultados mostraron que la finerenona (Kerendia™/Firialta™) reduce significativamente la proporción de albúmina a creatinina en orina, una medida del daño renal, en personas con enfermedad renal crónica (ERC) asociada con la diabetes tipo 1.
En la ERC, la hormona aldolsterona es hiperactiva, lo que provoca daño renal. La finerenona bloquea la actividad de esta hormona para proteger los riñones de un mayor daño. Finerenona ya ha sido aprobada para el tratamiento de la ERC en la diabetes tipo 2.
Finerenona fue bien tolerada, sin nuevos problemas de seguridad reportados y con pocos eventos adversos graves. Con base en estos resultados, Bayer planea presentar los datos para revisión regulatoria, con el objetivo de ampliar la indicación de finerenona para incluir el tratamiento de la ERC en personas con DT1.
La ERC es una de las complicaciones más comunes de la DT1. Casi un tercio de las personas con DT1 desarrollarán ERC, lo que aumenta el riesgo de insuficiencia renal y enfermedad cardiovascular.
Finerenona es la primera terapia en tres décadas que logra resultados positivos para la ERC en personas con DT1.
Breakthrough T1D colaboró estratégicamente con Bayer para apoyar el ensayo clínico FINE-ONE.
Dispositivos en el embarazo: ensayo CIRCUIT
Para evaluar la eficacia de un sistema de circuito cerrado en el embarazo, un ensayo clínico aleatorizado en Canadá y Australia, inscribió a mujeres embarazadas con diabetes tipo 1 antes de las 14 semanas de gestación, con seguimiento hasta las 6 semanas después del parto.
Analizaron a 88 participantes que fueron asignadas aleatoriamente a las 16 semanas de gestación a terapia de circuito cerrado o atención estándar. El grupo de atención estándar continuó con su método de administración de insulina previo a la aleatorización (múltiples inyecciones diarias o bomba de insulina) y todos los participantes utilizaron la monitorización continua de la glucosa durante todo el estudio.
El porcentaje medio de tiempo en el rango de glucosa específico del embarazo fue significativamente mayor en el grupo de circuito cerrado (65,4 % TIR) que en el grupo de atención estándar (50,3 % TIR); el nivel medio ajustado de glucosa también fue menor en el grupo de circuito cerrado que en el grupo de atención estándar.
Los hallazgos respaldan el uso de sistemas de circuito cerrado en el embarazo con diabetes tipo 1.
***
Breakthrough T1D Canada continuará monitoreando los resultados de estos ensayos y compartirá más actualizaciones a medida que estén disponibles.»

___