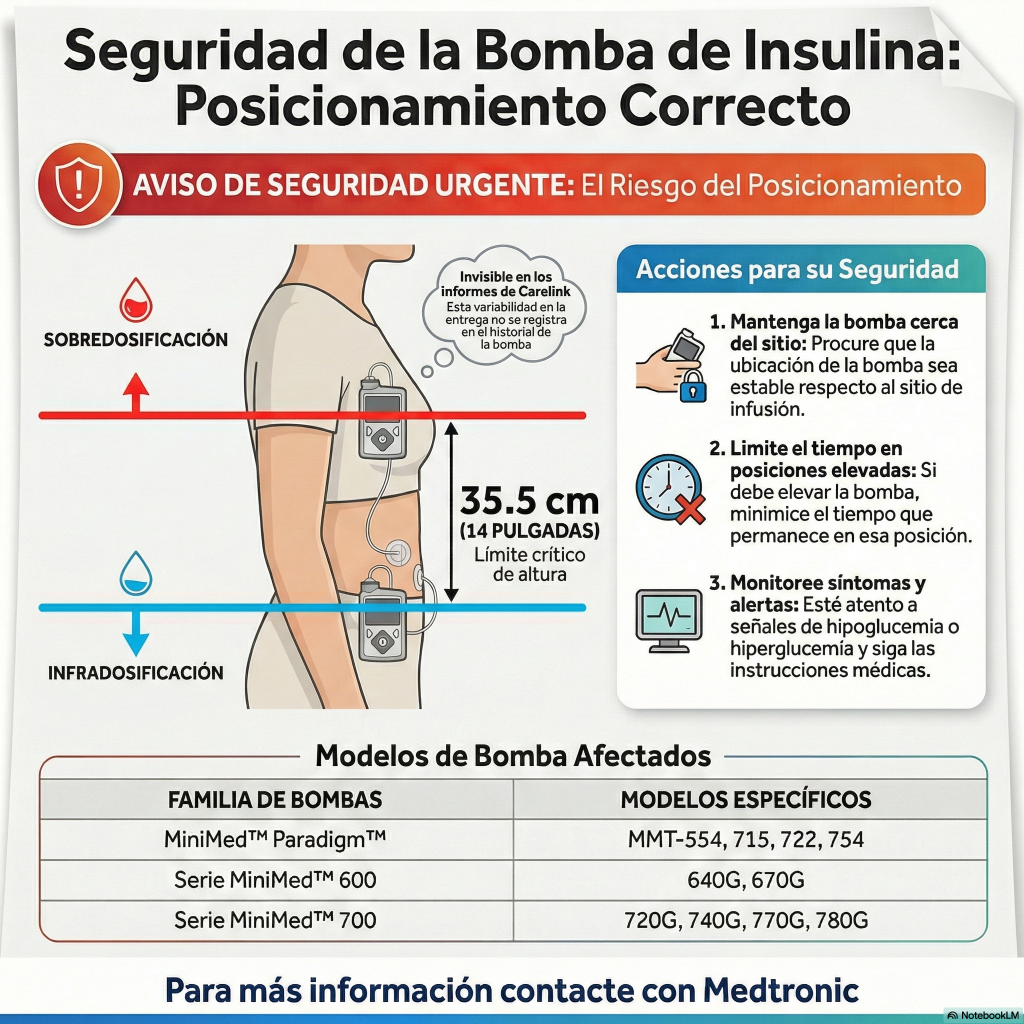
Los datos demuestran que las células de los islotes pancreáticos modificados hipoinmunes (HIP) de Sana, trasplantadas sin inmunosupresión, persisten y funcionan a lo largo del tiempo en pacientes con diabetes tipo 1.
Un estudio establece la capacidad de modificar genéticamente y trasplantar células de los islotes pancreáticos sin inmunosupresión y superar el rechazo tanto alogénico como autoinmune.
Los resultados del seguimiento de seis meses de los pacientes presentados en las 85.ª sesiones científicas anuales de la Asociación Americana de Diabetes (ADA) demuestran además que las células de los islotes pancreáticos modificados con HIP de Sana son seguras y bien toleradas, sobreviven, evaden la detección del sistema inmunitario y continúan produciendo insulina en el paciente.
Sana está incorporando su tecnología HIP para desarrollar SC451, una terapia derivada de células madre modificadas con HIP como tratamiento único para pacientes con diabetes tipo 1, con el objetivo de lograr niveles normales de glucosa en sangre sin insulina ni inmunosupresión.
La reciente reunión de la FDA INTERACT aumenta la confianza en el avance del banco de células maestro GMP para SC451 y en la presentación de la solicitud de nuevo fármaco en investigación (IND) para SC451 a partir de 2026.
Sana espera que los datos del estudio sean generalizables a múltiples tipos de células y poblaciones de pacientes.
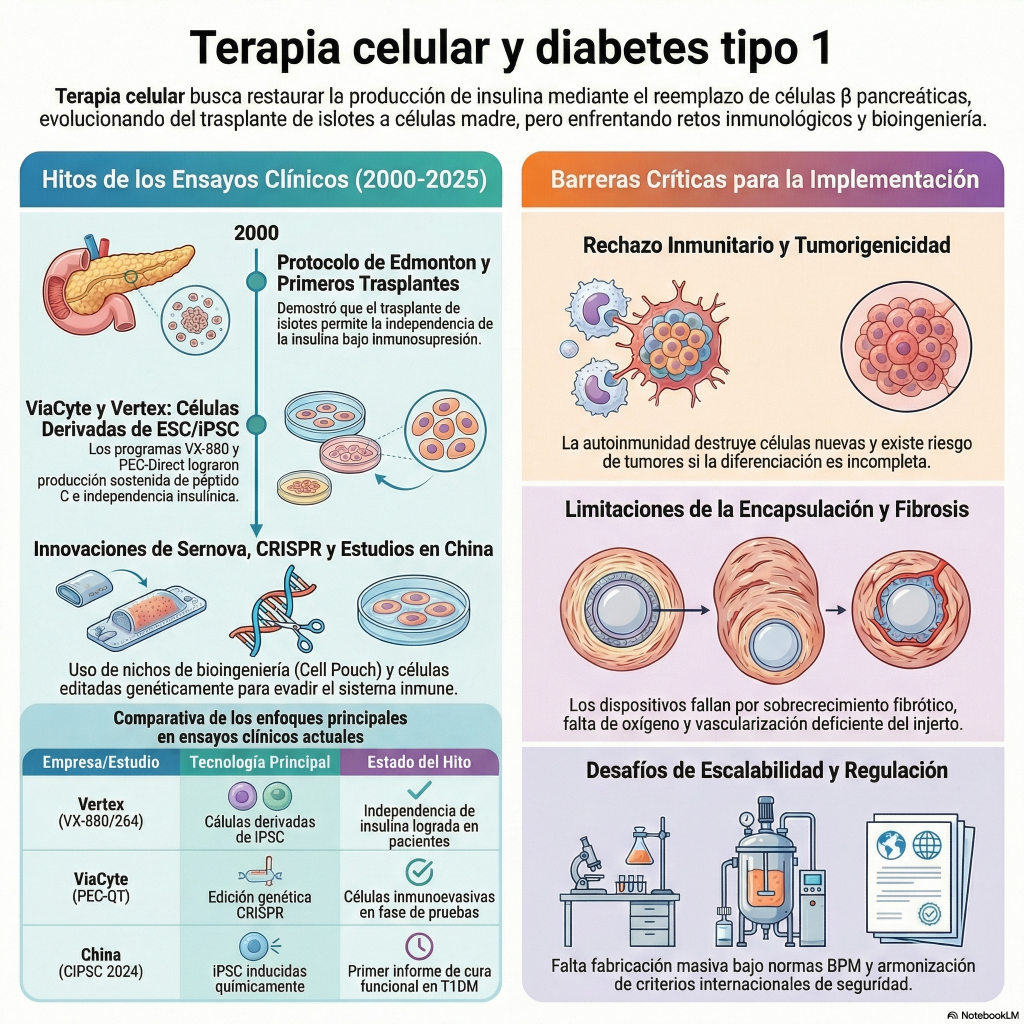
SEATTLE, 4 de agosto de 2025 (GLOBE NEWSWIRE) — Sana Biotechnology, Inc. (NASDAQ: SANA), empresa dedicada a cambiar las posibilidades de los pacientes mediante la ingeniería celular, anunció hoy la publicación en el New England Journal of Medicine (NEJM) de un artículo titulado «Supervivencia de células beta alogénicas trasplantadas sin inmunosupresión» (DOI: 10.1056/NEJMoa2503822). El artículo analiza los resultados de 12 semanas de un ensayo clínico patrocinado por investigadores, realizado en el Hospital Universitario de Uppsala, que evaluó el trasplante de UP421, una terapia primaria con células de islotes pancreáticos humanos diseñada con la tecnología hipoinmune (HIP) de Sana, sin el uso de inmunosupresores en un paciente de 42 años con diabetes tipo 1 desde hace más de tres décadas. El trasplante intramuscular de células de los islotes pancreáticos modificadas con HIP es seguro y bien tolerado, y demuestra que estas células evaden el reconocimiento inmunitario autoinmune y alogénico, persisten y secretan insulina de forma dependiente de la glucosa durante el período de evaluación de 12 semanas descrito en el artículo. La tomografía por emisión de positrones (TEP)-resonancia magnética (RM) de 12 semanas también confirmó la presencia de células de los islotes en el sitio del trasplante. Los datos de seis meses, que se describen a continuación, se presentaron recientemente en la reunión de la ADA y hoy en el Congreso Mundial de Trasplantes de 2025, coincidiendo con la publicación del artículo del NEJM.
«Estamos encantados de que los resultados de este estudio, que creemos que representan un avance tanto científico como médico, hayan sido reconocidos en el New England Journal of Medicine «, afirmó el Dr. Per-Ola Carlsson, investigador principal del estudio, médico sénior y profesor de la Clínica de Endocrinología y Diabetología del Hospital Universitario de Uppsala. La diabetes tipo 1 es una enfermedad en la que el sistema inmunitario destruye las células beta de los islotes pancreáticos, lo que requiere que el paciente reciba terapia con insulina de por vida para controlar los niveles de glucosa. Si bien está bien establecido que el trasplante de células de los islotes pancreáticos a una dosis terapéutica objetivo puede permitir previsiblemente que los pacientes con diabetes tipo 1 vivan sin terapia con insulina, hasta ahora estos pacientes deben someterse a una inmunosupresión significativa de por vida, que con frecuencia es tóxica y difícil de tolerar. Este estudio demuestra que los nuevos islotes pancreáticos modificados con HIP de Sana restauran la producción de insulina sin necesidad de inmunosupresión, un resultado transformador y un paso significativo hacia una cura funcional y ampliamente accesible para pacientes con diabetes tipo 1. El paciente produce su propia insulina por primera vez en más de 35 años.
“Estos resultados revisados por pares, basados en los extensos estudios preclínicos y translacionales de la Dra. Sonja Schrepfer y el equipo de Sana, refuerzan nuestra creencia de que Sana tiene la capacidad de desarrollar una cura funcional para la amplia población de personas que viven con diabetes tipo 1”, dijo Steve Harr, MD, presidente y director ejecutivo de Sana. Los datos, junto con los comentarios recientes de la FDA sobre nuestro banco de células madre modificado con HIP para la fabricación según las BPM y nuestro plan de pruebas preclínicas para SC451, refuerzan nuestra confianza en nuestro objetivo de tratar la diabetes tipo 1: un tratamiento único sin inmunosupresión que conduce a niveles normales de glucosa en sangre a largo plazo sin insulina exógena. Esperamos presentar una solicitud de autorización de comercialización (IND) para SC451, una terapia de islotes pancreáticos derivada de células madre modificada con HIP de última generación, a partir de células madre, ya en 2026 y comenzar las pruebas de fase 1 poco después. Quiero agradecer a todo el equipo de Sana, a los investigadores de Uppsala y al paciente que se ofreció como voluntario para este estudio transformador, el primero en humanos.
El Dr. James Shapiro, profesor de Cirugía, Medicina y Oncología Quirúrgica de la Universidad de Alberta y líder del equipo clínico que desarrolló el Protocolo de Edmonton para el trasplante de células de los islotes, añadió: «La terapia con insulina exógena sigue siendo una terapia que salva vidas a corto plazo, pero no logra replicar la regulación precisa y dinámica de la glucosa de un páncreas sano, lo que deja a los pacientes susceptibles a complicaciones médicas tanto a corto como a largo plazo. Esta limitación nos motivó a mi equipo y a mí a ser pioneros en un protocolo para el trasplante de células de los islotes con inmunosupresión y a seguir innovando en este campo. Los datos presentados en el artículo del NEJM, que demuestran que las células de los islotes trasplantadas y modificadas genéticamente pueden evadir la destrucción inmunomediada y responder adecuadamente a las demandas de insulina, representan un avance significativo en la búsqueda continua de una cura definitiva para la diabetes tipo 1 y respaldan mi firme convicción de que el futuro del tratamiento de la diabetes tipo 1 reside en las terapias basadas en células madre».
Principales hallazgos del estudio en curso
- No se identificaron en el estudio eventos adversos graves ni eventos adversos posible o probablemente relacionados con UP421.
- Las células de los islotes pancreáticos modificadas con HIP, trasplantadas sin medicamentos inmunosupresores, incluidos los glucocorticoides, evaden la detección inmunitaria y el rechazo.
- Las células de los islotes pancreáticos sobreviven y funcionan después del trasplante.
- La supervivencia y la función de las células beta pancreáticas modificadas con HIP se confirmaron en cada extracción de sangre, medida por la presencia de péptido C circulante, un biomarcador que indica que las células beta trasplantadas están produciendo insulina.
- Los niveles de péptido C aumentan durante las pruebas mensuales de tolerancia a comidas mixtas (MMTT), lo que muestra un aumento de la secreción de insulina en respuesta a una comida. Cabe destacar que, antes del trasplante, el paciente presentaba niveles indetectables de péptido C tanto en ayunas como durante una MMTT.
- Las exploraciones de resonancia magnética realizadas cada mes muestran una señal sostenida y consistente en el sitio del trasplante de células, lo que es consistente con la supervivencia del injerto.
- Una exploración PET-MRI con un trazador dirigido a las células beta pancreáticas confirma que las células supervivientes son, de hecho, células beta pancreáticas.
Acerca del estudio de UP421 en diabetes tipo 1 patrocinado por investigadores del Hospital Universitario de Uppsala
El estudio de UP421 patrocinado por investigadores cuenta con el apoyo de una beca de The Leona M. and Harry B. Helmsley Charitable Trust. El estudio evalúa si las células pancreáticas productoras de insulina diseñadas por HIP pueden trasplantarse de forma segura y ayudar a recuperar la producción de insulina en personas con diabetes tipo 1 sin necesidad de tratamiento simultáneo con medicamentos inmunosupresores. Para ello, UP421 se diseña utilizando la plataforma HIP de Sana en el Hospital Universitario de Oslo. El estudio implica el trasplante quirúrgico intramuscular de células de islotes diseñadas por HIP primarias o derivadas de donantes en el antebrazo de pacientes con diabetes tipo 1. El objetivo principal del estudio es investigar la seguridad del trasplante de UP421 en pacientes con diabetes tipo 1, con criterios de valoración secundarios que incluyen la supervivencia celular, la evasión inmunitaria y la producción de péptido C. El péptido C circulante es una medida de la producción endógena de insulina. Este primer estudio en humanos examina una dosis baja de islotes primarios modificados con HIP para establecer inicialmente la seguridad y la función de los islotes modificados con HIP sin inmunosupresión y, como resultado, no pretende mostrar una mejora en la glucemia o una reducción en la administración de insulina exógena.
Los resultados de 12 semanas se han publicado en el New England Journal of Medicine y los resultados de seis meses se presentaron en la 85.ª reunión científica anual de la Asociación Americana de Diabetes (ADA) el 23 de junio de 2025, así como en el Congreso Mundial de Trasplantes 2025 el 4 de agosto de 2025.
Los resultados del estudio, realizado durante seis meses tras el trasplante de células de los islotes pancreáticos, demuestran la supervivencia y la función de las células beta pancreáticas hasta el sexto mes, medida mediante la presencia de péptido C circulante, un biomarcador que indica que las células beta trasplantadas producen insulina. Los niveles de péptido C también aumentan durante un MMTT, en consonancia con la secreción de insulina en respuesta a una comida. Al inicio, el paciente presentaba niveles indetectables de péptido C tanto en ayunas como durante un MMTT. La plataforma HIP ha logrado una prueba de concepto en humanos, demostrando la evasión del reconocimiento inmunitario, con una posible aplicación amplia para el trasplante alogénico sin inmunosupresión.
Acerca de la Plataforma Hipoinmune (HIP) de Sana Biotechnology.
La plataforma HIP de Sana está diseñada para generar células ex vivo que pueden evadir el sistema inmunitario del paciente y permitir el trasplante de células alogénicas sin necesidad de inmunosupresión. Aplicamos la tecnología HIP para desarrollar candidatos terapéuticos a gran escala, incluyendo células madre pluripotentes, que luego pueden diferenciarse en múltiples tipos celulares, como células de los islotes pancreáticos y células T CAR alogénicas derivadas de donantes. Nosotros y nuestros colaboradores hemos generado una importante propiedad intelectual fundacional en este campo. Los primeros datos clínicos de los ensayos de Fase 1 y los datos preclínicos publicados en revistas con revisión por pares demuestran, en diversos tipos celulares, que estas células alogénicas trasplantadas son capaces de evadir tanto las ramas innatas como adaptativas del sistema inmunitario, manteniendo al mismo tiempo su actividad. Los programas más avanzados de Sana que utilizan esta plataforma incluyen un programa de células de islotes pancreáticos derivados de células madre para la diabetes tipo 1, un programa CAR T alogénico para enfermedades autoinmunes mediadas por células B y un programa CAR T alogénico dirigido a cánceres CD22+.
Acerca de Sana.
Sana Biotechnology, Inc. se centra en la creación y administración de células modificadas genéticamente como medicamentos para pacientes. Compartimos la visión de reparar y controlar genes, reemplazar células faltantes o dañadas y hacer que nuestras terapias estén ampliamente disponibles para los pacientes. Somos un grupo apasionado de personas que trabajamos juntas para crear una empresa perdurable que cambie la forma en que el mundo trata las enfermedades. Sana tiene operaciones en Seattle, Washington; Cambridge, Massachusetts; South San Francisco, California; y Bothell, Washington.
Nota de advertencia sobre las declaraciones prospectivas
Este comunicado de prensa contiene declaraciones prospectivas sobre Sana Biotechnology, Inc. (la «Compañía», «nosotros», «nos» o «nuestro») dentro del significado de las leyes federales de valores, incluidas las relacionadas con la visión, el progreso y los planes comerciales de la Compañía; las expectativas para sus programas de desarrollo, productos candidatos y plataformas tecnológicas, incluidos sus planes de desarrollo preclínico, clínico y regulatorio y las expectativas de tiempo, incluido el momento de la presentación de solicitudes de nuevos fármacos en investigación y el comienzo de las pruebas de Fase 1, el impacto de la reunión y los comentarios de FDA INTERACT y la capacidad de avanzar con el banco de células maestro editado por HIP de la Compañía para la fabricación de GMP y el plan de pruebas no clínicas para SC451, y la capacidad potencial de SC451 para ser un tratamiento de una sola vez para pacientes con diabetes tipo 1 sin inmunosupresión y para lograr una glucemia normal sin insulina exógena; El impacto y la importancia potenciales de los datos de estudios preclínicos y clínicos de los productos y tecnologías candidatos de la Compañía, incluido el estudio UP421 de trasplante de células de islotes sin inmunosupresión en la diabetes tipo 1 («Estudio»), incluida la capacidad potencial de desarrollar una cura funcional y ampliamente accesible para la amplia población de personas que viven con diabetes tipo 1, el potencial de que los datos del Estudio se puedan generalizar a múltiples tipos de células y poblaciones de pacientes, y las posibles implicaciones para el programa SC451 de la Compañía; las expectativas con respecto al papel de las terapias basadas en células madre en el futuro del tratamiento de la diabetes tipo 1; la capacidad potencial de la plataforma HIP para tener una amplia aplicación y generar células ex vivo.que pueden evadir el sistema inmunitario del paciente para permitir el trasplante de células alogénicas sin necesidad de inmunosupresión, y que se aplicarán para desarrollar candidatos terapéuticos a gran escala, incluyendo células madre pluripotentes, que pueden diferenciarse en múltiples tipos celulares, y células T CAR alogénicas derivadas de donantes; la posible seguridad y supervivencia, función y evasión inmunitaria de células de islotes pancreáticos primarios modificados con HIP trasplantadas intramuscularmente sin inmunosupresión; y declaraciones realizadas por el Investigador Principal del Estudio, Médico Sénior y Profesor de la Clínica de Endocrinología y Diabetología del Hospital Universitario de Uppsala, declaraciones realizadas por el Presidente y Director Ejecutivo de la Compañía, y declaraciones realizadas por el Profesor de Cirugía, Medicina y Oncología Quirúrgica de la Universidad de Alberta. Todas las declaraciones que no sean declaraciones de hechos históricos contenidas en este comunicado de prensa, incluyendo, entre otras, declaraciones sobre la estrategia, expectativas, operaciones futuras y perspectivas de la Compañía, son declaraciones prospectivas. En algunos casos, las declaraciones prospectivas se pueden identificar por términos como «objetivo», «anticipar», «asumir», «creer», «contemplar», «continuar», «podría», «diseño», «debido», «estimar», «esperar», «meta», «pretender», «puede», «objetivo», «planificar», «posicionado», «potencial», «predecir», «buscar», «debería», «objetivo», «hará», «sería» y otras expresiones similares que son predicciones o indican eventos y tendencias futuras, o la forma negativa de estos términos u otra terminología comparable. La Compañía ha basado estas declaraciones prospectivas en gran medida en sus expectativas, estimaciones, pronósticos y proyecciones actuales sobre eventos futuros y tendencias financieras que cree que pueden afectar su situación financiera, resultados de operaciones, estrategia comercial y necesidades financieras. Dadas las importantes incertidumbres en estas declaraciones prospectivas, no debe confiar en ellas como predicciones de eventos futuros. Estas declaraciones están sujetas a riesgos e incertidumbres que podrían causar variaciones sustanciales en los resultados reales, incluyendo, entre otros, los riesgos inherentes al desarrollo de fármacos, como los asociados con el inicio, el coste, el plazo, el progreso y los resultados de los programas de investigación y desarrollo actuales y futuros de la Compañía, los ensayos preclínicos y clínicos, así como las perturbaciones económicas, del mercado y sociales. Para un análisis detallado de los factores de riesgo que podrían afectar los resultados reales de la Compañía, consulte los factores de riesgo identificados en los informes de la Compañía ante la Comisión de Bolsa y Valores (SEC), incluyendo, entre otros, su Informe Trimestral en el Formulario 10-Q de fecha 8 de mayo de 2025. Salvo que lo exija la ley, la Compañía no asume ninguna obligación de actualizar públicamente ninguna declaración prospectiva por ningún motivo.
Relaciones con inversores y medios:
Nicole Keith
investor.relations@sana.com
media@sana.com